液相色谱-串联质谱法临床样品前处理专家共识
近年来,各种检验新理论和新技术不断涌现,极大地推动了临床检验学科的发展。液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)集色谱技术的高分离能力和质谱技术的高选择性、高特异性及高灵敏性的优点于一体,有效避免了免疫法的非特异性干扰等缺陷,日益受到国内外临床检验界的青睐,成为临床检验领域最具有生命力的新技术之一[1,2,3]。LC-MS/MS广泛应用于小分子化合物的定性与定量检测,对于LC-MS/MS而言,生物样品的前处理是十分必要的。样品前处理旨在从复杂的生物基质中提取小分子目标分析物,去除生物基质中的大分子、盐、脂类以及其他杂质,减少目标分析物在质谱上受到的基质效应以及其他物质的干扰。首先,由于人体血液样品不易获得,所以要求取样量尽量少,同时应尽量避免由样品前处理不当导致的重新取样;其次,多数小分子化合物在人体的含量较低,一般在pg/ml至ng/ml水平,且生物样本基质复杂,内源性干扰物较多,质谱分析前需要尽可能纯化样品[4];另外,质谱仪本身的耐污染能力较低,要求进样引入的干扰物尽量少。杂质和干扰越少,离子源沉积污染物越少,离子化效率更稳定,质谱响应更高,信号更稳定。
样品前处理方法的选择应综合考虑目标分析物的浓度水平、理化性质、样品的基质类型、仪器的灵敏度和抗干扰能力等实际情况。
“人机料法环”是对全面质量管理理论中的5个影响产品质量的主要因素的简称,这5个环节也是临床液相色谱-串联质谱法临床样品前处理的关键要素。只有把控好这5个环节,才能确保临床检验的真实性、准确性和可靠性。
人:样品前处理对人员的要求
技术人员宜具备临床检验、分析化学、药物分析专业知识或质谱应用等经验、或受过相关培训等经历,了解目标分析物的化学性质以及需熟练掌握色谱、质谱技术理论、仪器设备使用维护、检验项目标准操作规程、质量控制方法、化学品尤其是危化品管理等相关知识,技术人员须进行岗前培训及考核,考核通过后方可上岗[13]。
机:仪器特点及分类
·质谱仪

表1 常见临床LC-MS/MS检测项目推荐的样品前处理方法及质谱仪灵敏度要求
注:(1)推荐前处理方法和适用机型仅供参考,具体检测项目的前处理方法和适用机型,需要根据各实验室的检测条件和需求确定。(2)对于浓度低或者质谱离子化效率低的化合物,可以采用衍生化的方法提高化合物的灵敏度,满足更多Ⅰ、Ⅱ仪器的检测要求
料:样品前处理相关试剂与辅助耗材重点要求
临床LC-MS/MS前处理常用试剂见表2。
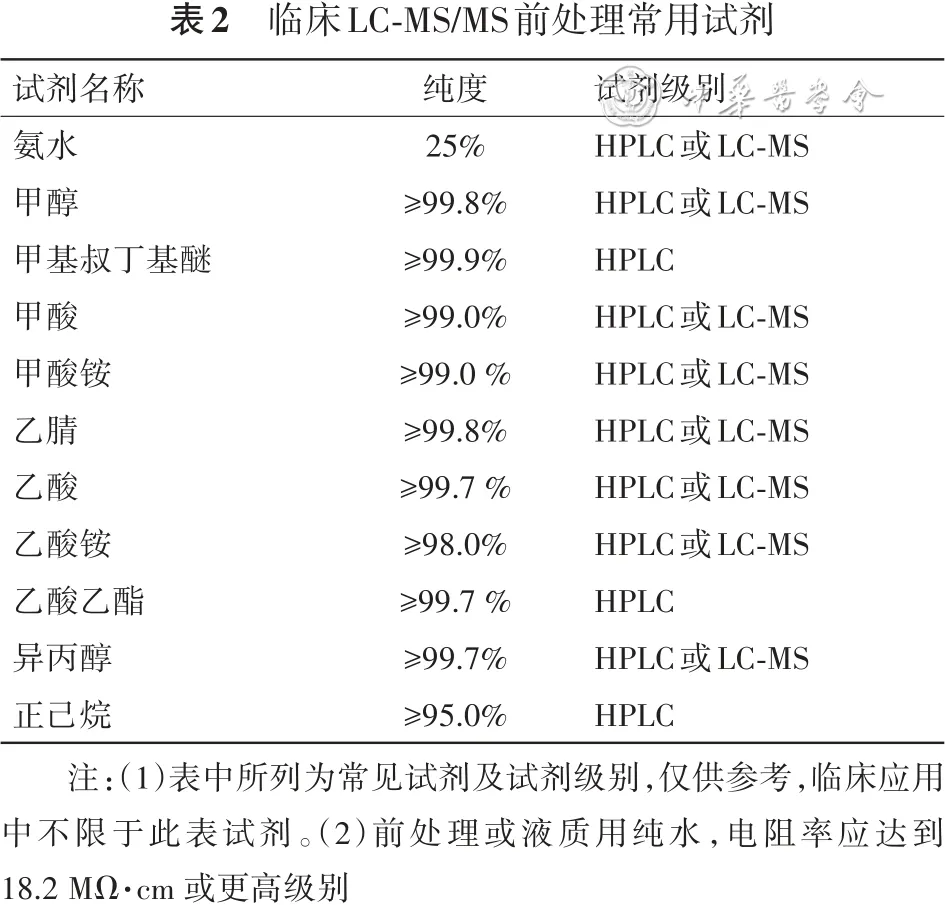
表2 临床LC-MS/MS前处理常用试剂
注:(1)表中所列为常见试剂及试剂级别,仅供参考,临床应用中不限于此表试剂。(2)前处理或液质用纯水,电阻率应达到 18.2 MΩ·cm 或更高级别
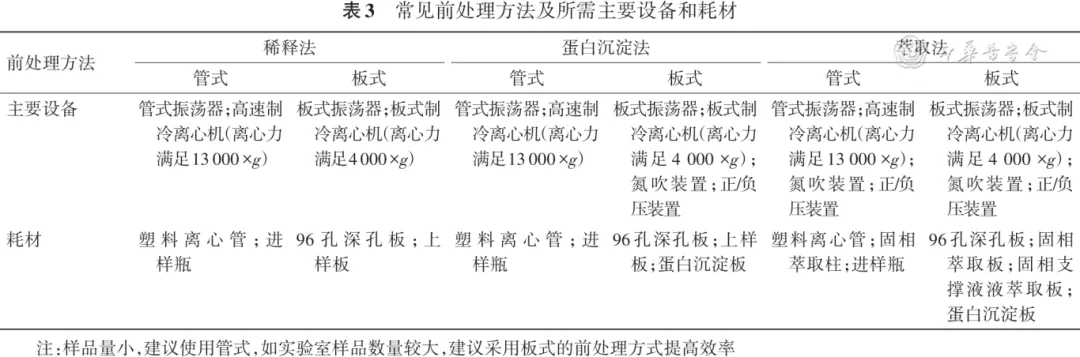
表3 常见前处理方法及所需主要设备和耗材
注:样品量小,建议使用管式,如实验室样品数量较大,建议采用板式的前处理方式提高效率

表4 常见检测项目样本类型及保存条件表
法:前处理方法原理及应用
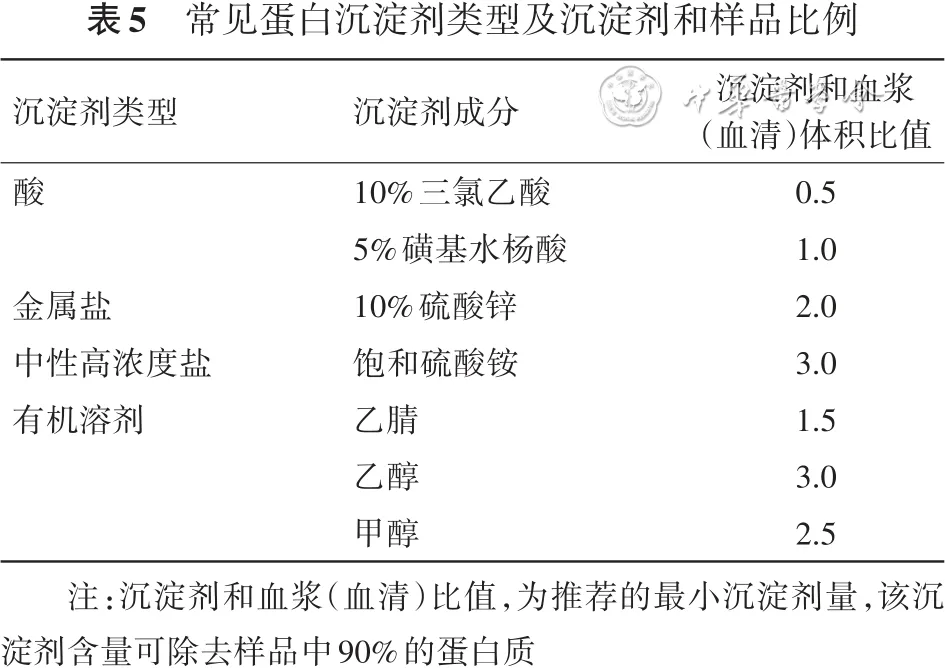
表5 常见蛋白沉淀剂类型及沉淀剂和样品比例
注:沉淀剂和血浆(血清)比值,为推荐的最小沉淀剂量,该沉淀剂含量可除去样品中90%的蛋白质

表6 SPE类型、保留机制和应用
注:SPE,固相萃取法;MAX,强阴离子交换色谱柱;MCX,强阳离子交换色谱柱;WCX,弱阳离子交换色谱柱;WAX,弱阴离子交换色谱柱
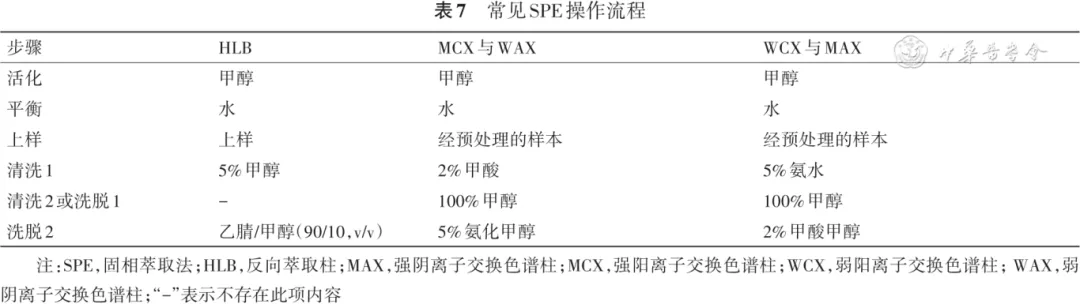
表7 常见SPE操作流程
注:SPE,固相萃取法;HLB,反向萃取柱;MAX,强阴离子交换色谱柱;MCX,强阳离子交换色谱柱;WCX,弱阳离子交换色谱柱;WAX,弱阴离子交换色谱柱;“-”表示不存在此项内容
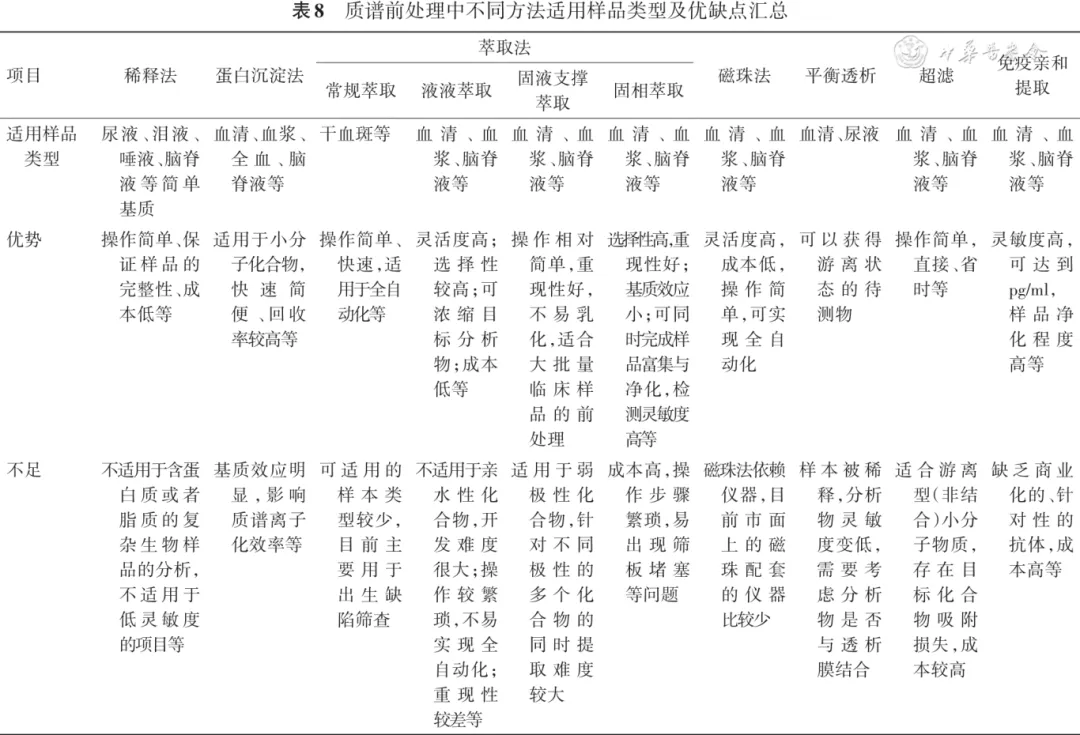
表8 质谱前处理中不同方法适用样品类型及优缺点汇总
建议11:免疫亲和提取中的亲和柱需要平衡至室温,再进行样本提取;对于超过亲和柱载量的样本,需要减少上样体积进行检测。
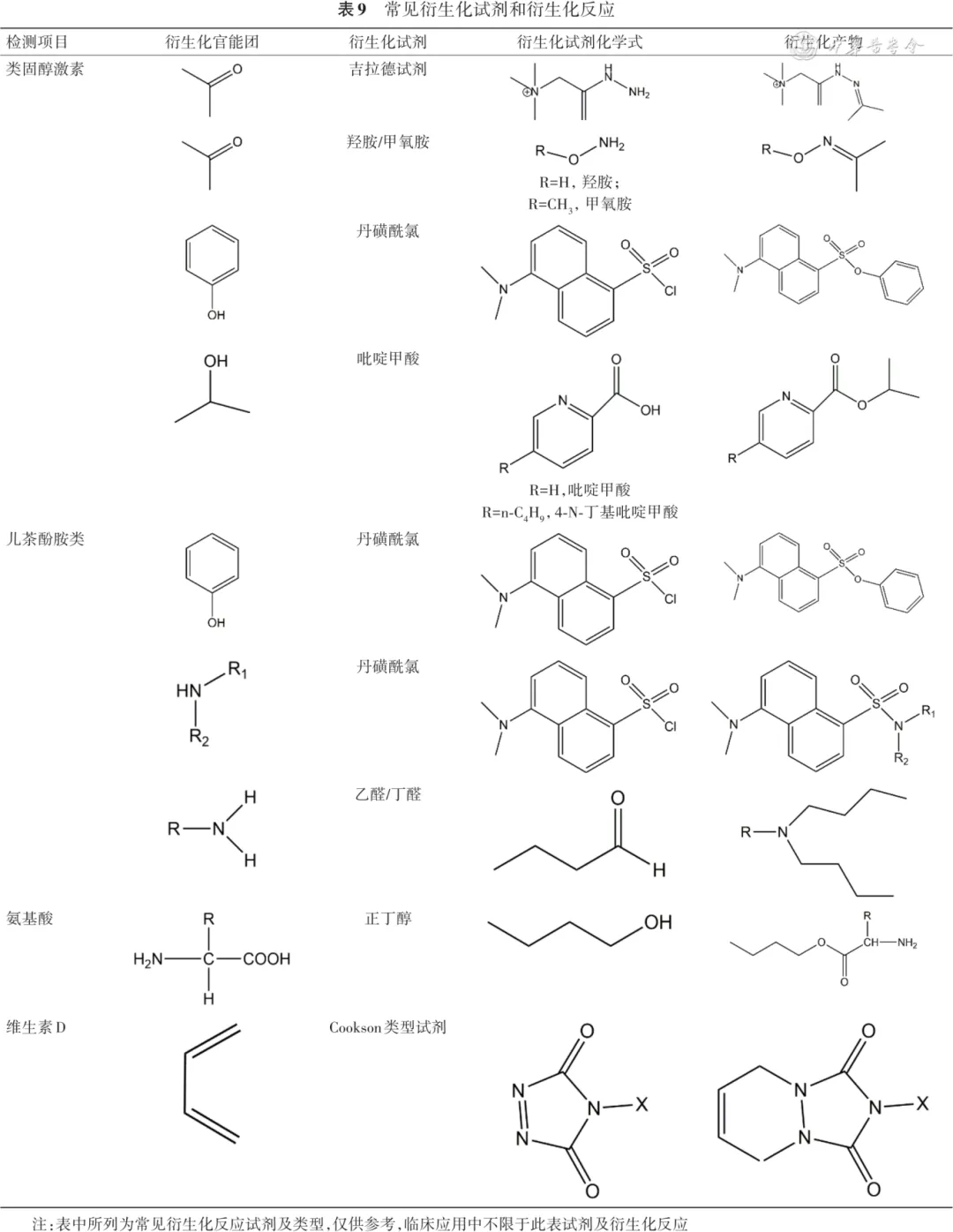
表9 常见衍生化试剂和衍生化反应
注:表中所列为常见衍生化反应试剂及类型,仅供参考,临床应用中不限于此表试剂及衍生化反应

表10 衍生法与非衍生法对比
环:样品前处理对环境的要求
前处理操作应在单独的区域进行,在样品前处理区配备足够的通风设施,必要时实施安全风险评估。前处理过程中可能涉及到易挥发性的试剂(如甲醇、乙腈、正己烷、挥发性无机酸等)的操作时,应在通风橱中完成。因外,充分考虑不同操作步骤可能存在的挥发性气体损害风险,还应配备万向排风罩等通风设备,以保障实验室人员安全[13]。实验室工作人员在操作过程中应根据情况佩戴口罩、帽子和手套等。见光易分解的物质,实验操作间应具备避光条件。应配备消防器材、冲淋装置、洗眼装置以及急救箱等应急装备。送检样本如不能立刻处理,应根据样本类型和各项目的检测需求,保存样本。如部分检测项目需要避光保存(如维生素);常温保存(如肾素浓度[15]);冷藏保存(儿茶酚胺);血浆样本如不能立刻检测,建议分装保存,避免溶血。
·内标的加入:前处理前即加入同位素内标并充分平衡待测物和内标,用于校正样本提取、HPLC进样、质谱离子化和检测中产生误差。
·样本离心:样本离心前保存温度过高或离心力过大,导致样本溶血或者破碎。
·抗凝剂:对于加入抗凝剂的样本需要及时摇匀,防止出现血凝块。
·样本类型:血浆样本的项目要选择合适的抗凝剂,减少凝血形成;血清样本应评价分离胶是否对待测物检测有影响。
·震荡和离心:样本前处理操作需要控制震荡力度、离心力、离心时间等条件。
·环境温度及避光:对于特殊项目,需要控制样本前处理的环境温度及光照条件等。
·样本储存:实验室应评估检测项目的稳定性,及时对样品进行检测,未能及时检测的样品应储存在适宜的温度、湿度、避光等条件下。
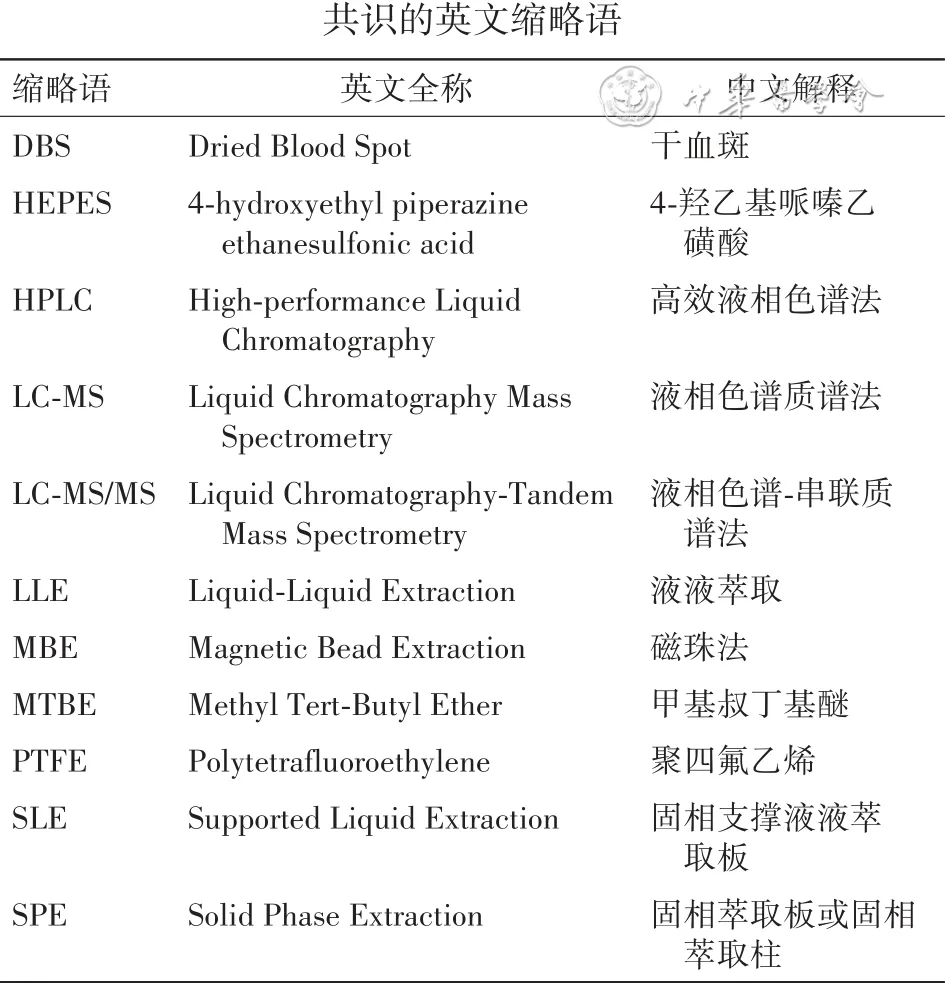
附录A
共识中的英文缩略语
附录B
前处理方法应用典型实例
以下实例仅供参考。
B.1稀释法
典型实例:LC-MS/MS方法测定尿液样品中的肌酐含量[19]。
(1)96孔板中加入200μl的同位素内标的乙腈工作液。
(2)加入40μl的样品、校准样品或质控样品,密封后涡旋混匀3min。
(3)3000×g离心5min。将上清液转移至96孔板中,然后注入LC-MS/MS进样分析。
B.2蛋白沉淀法
典型实例:LC-MS/MS方法测定人血清中伏立康唑、泊沙康唑、氟康唑和伊曲康唑 [20]。
(1)取100μl的样品、校准样品或质控样品,加入200μl含 0.1%甲酸乙腈的沉淀剂(仅供参考)和100μl的内标溶液(乙腈),涡旋混匀。
(2)17000×g离心10min,去除蛋白质。取上清液50μl,然后补加100μl50%甲醇水溶液。涡旋混匀,上机。
B.3常规萃取法
典型实例:新生儿遗传代谢病筛查[21]。
(1)用打孔器将采集的高低水平质控血斑及待测样本血斑打出3mm直径的血片,按顺序置于96孔板中,然后每孔加入100μl内标工作液(溶剂信息未提供)。
(2)密封,在45 ℃条件下孵育震荡(130~150g)45min然后转移萃取液75μl至上样板中,进样分析。
B.4液液萃取
典型实例:LC-MS/MS方法测定人血清样品中脂溶性维生素[22]。
(1)取200μl的血清样品加入到塑料离心管中,然后加入30μl的乙酸视黄醇(保护剂),最后加入800μl的甲醇溶液(含有同位素内标),密封,涡旋混匀30s。
(2)16000×g离心10min,然后收集上清液,加入800μl的正己烷,涡旋混匀;此步骤可重复2次,从而提高目标分析物的提取回收率。
(3)收集正己烷层,并在45 ℃的真空条件下蒸发至干。
(4)将残留物溶于100μl甲醇中,进样分析。
B.5固液支撑萃取
典型实例:LC-MS/MS法测定人血浆中醛固酮[23]。
(1)取450μl的血浆样品、校准品或质控品,然后加入450μl的50%甲醇配制的同位素内标溶液,剧烈涡旋混匀。
(2)将上述溶液800μl转移至SLE板,然后静置5min。
(3)分两次加入2.5ml的MTBE萃取剂进行洗脱,然后将有机试剂在氮气下吹干。
(4)120μl的35%的甲醇/水复溶,上机检测。
B.6固相萃取
典型实例:LC-MS/MS法测定人血清或血浆中的类固醇激素[24]。
(1)取100μl血清或血浆样品,然后加入10μl混合内标工作液(甲醇),最后加入100μl甲醇溶液,涡旋混匀1min。
(2)补加100μl蒸馏水,涡旋混匀,然后离心,移取200μl上清进行SPE的程序。
(3)SPE程序(仅供参考,实验室可自行设计方法):
a. 活化和平衡:亲水亲脂平衡SPE柱(简称HLB)中先后加入200μl甲醇和水。
b. 上样:将200μl样品上清溶液加入已活化的SPE提取板中。
c. 淋洗:加入200μl甲醇:水(1∶9,V/V)进行一次淋洗,然后再加入200μl的正己烷溶液分别进行第二次淋洗。
d. 洗脱:加入40μl乙腈:甲醇(9∶1,V/V)进行洗脱,收集洗脱液,然后向收集板中加入60μl蒸馏水。
B.7磁珠法
典型实例:LC-MS/MS法测定人血浆中的儿茶酚胺及其代谢物[17]。
(1)准备含有磁珠(活化液)、平衡液、漂洗液和洗脱液的96孔预分装板。
(2)在96孔预分装的样品列加入400μl的样本,然后再加入400μl的同位素内标溶液。
(3)将加入样品的96孔预分装板加入到全自动样品处理系统(如EX-48),仪器自动进行磁珠的活化、平衡、吸附目标分析物、漂洗、洗脱等过程。
(4)完成提取程序,上机检测。
B.8超滤法
典型实例:LC-MS/MS法测定人血清中游离睾酮[25]。
(1)样品稀释:取500μl的血清加入500μl的4-羟乙基哌嗪乙磺酸(HEPES)缓冲液稀释血清。
(2)超滤离心:将上述样品加入到超滤装置中,然后1800×g,25 ℃,离心1h。
(3)加入内标:将40fmol睾酮的同位素内标加入到超滤液中,涡旋混匀,孵育5min。
(4)游离睾酮的萃取:向超滤液中加入1ml的甲基叔丁基醚(MTBE)萃取,40 ℃氮气下挥干。
(5)去除杂质:1ml的90%的甲醇重组,加入1ml的庚烷,将底部的甲醇加入到洁净管中,氮气吹干。
(6)重组上机:70μl的50%的甲醇复溶,上机检测。
B.9平衡透析
典型实例:LC-MS/MS法测定游离甲状腺激素[26]。
(1)透析缓冲溶液配制:按照CLSI C45A指南的建议配制HEPES透析缓冲溶液。
(2)加样:96孔透析板中蓝色一侧加入200μl的透析缓冲液,透明一侧加入200μl的样本或质控样本。
(3)透析:将透析装置放入37 ℃恒温孵育箱中,旋转17~19h,完成透析。
(4)平衡至室温:从孵育箱中取出透析板在室温平衡30min。
(5)加入同位素内标:取150μl的透析液加入到96孔板中,然后加入200μl的同位素内标工作液,涡旋混匀。
(6)校准曲线配制:取150μl的校准品加入200μl的同位素内标工作液,涡旋混匀。
(7)上机检测:将样本和校准曲线转移至上样板中,进行LC-MS/MS分析。
B.10免疫亲和提取
典型实例:LC-MS/MS法测定人血清中1,25-双羟维生素D[27]。
(1)免疫萃取:向每个含200μl的固定抗体的反应杯中加入500μl 的血清样品,加入25μl的内标溶液,涡旋混匀孵育60min。
漂洗:加入500μl的水漂洗三次,5000 ×g离心1min。
(2)洗脱:加入400μl的乙醇洗脱。
(3)氮吹重组:洗脱液真空干燥,加入(7∶3,V/V)的甲醇水重组上机分析。
B.11衍生法
典型实例:LC-MS/MS法测定干血斑中的氨基酸和酰基肉碱[28]。
(1)取1~2个滤纸血点(直径3mm的干血滤纸片,相当于3.2μl全血),置于96孔过滤板中,每孔加入含氨基酸和酰基肉碱同位素内标的无水甲醇100μl,室温放置20min,以提取血片中的氨基酸和酰基肉碱。然后离心转移上清至另一个96孔板中,氮气保护下50 ℃吹干,加入60μl正丁醇(含3mol/L HCl),密封,65 ℃孵育15min进行衍生化。
(2)衍生后的溶液,在氮气保护下50 ℃吹干。用100μl 流动相(一般为乙腈∶水∶甲酸=80∶20∶0.02)复溶,取20μl进样,上机分析。
参考文献
[2] Rappold BA . Review of the Use of Liquid Chromatography-Tandem Mass Spectrometry in Clinical Laboratories: Part I-Development[J]. Ann Lab Med, 2022,42(2):121-140. DOI: 10.3343/alm.2022.42.2.121 .
[3] Rappold BA . Review of the Use of Liquid Chromatography-Tandem Mass Spectrometry in Clinical Laboratories: Part II-Operations[J]. Ann Lab Med, 2022,42(5):531-557. DOI: 10.3343/alm.2022.42.5.531 .
[4] 冯健男,杜守颖,白洁,等. 生物样品前处理的研究进展[J]. 中国中药杂志, 2014,39(21):4143-4148.
[5] Kole PL , Venkatesh G , Kotecha J ,et al. Recent advances in sample preparation techniques for effective bioanalytical methods[J]. Biomed Chromatogr, 2011,25(1-2):199-217. DOI: 10.1002/bmc.1560 .
[6] Zhou W , Li H , Dong J ,et al. Serum cholesterol measured by isotope dilution liquid chromatography tandem mass spectrometry[J]. Clin Chem Lab Med, 2011,49(4):669-676. DOI: 10.1515/CCLM.2011.093 .
[7] 中国医师协会检验医师分会临床质谱检验医学专业委员会, 液相色谱串联质谱临床检测方法的开发与验证[J]. 检验医学, 2019,34(3):189-196. DOI: 10.3969/j.issn.1673-8640.2019.03.001 .
[8] 王娴,常颖,王佳佳,等. 高效液相串联质谱法检测人血清中总胆碱[J]. 中华预防医学杂志, 2011,45(09):833-835. DOI: 10.3760/cma.j.issn.0253-9624.2011.09.015 .
[9] 刘琳,许正文,孟兰兰,等. 液相串联质谱在妇幼健康领域的应用与挑战[J]. 中华预防医学杂志, 2022,56(10):1520-1526. DOI: 10.3760/cma.j.cn112150-20220329-00298 .
[10] 刘仲,于志刚,王艳华,等. 人尿液中8-羟基脱氧鸟苷的超高效液相色谱-串联质谱联用检测方法[J]. 中华预防医学杂志, 2016,50(4):357-361. DOI: 10.3760/cma.j.issn.0253-9624.2016.04.014 .
[11] Liu Z , Jin L , Zhang J ,et al. Development of a designed comparison method based on isotope dilution liquid chromatography-tandem mass spectrometry for determining plasma renin activity and its clinical assessment of renin activity stability in plasma[J]. Anal Methods, 2023,15(4):492-501. DOI: 10.1039/d2ay01646j .
[12] Deng Y , Zhang C , Wang J ,et al. An Accurate Isotope Dilution Liquid Chromatography-Tandem Mass Spectrometry Method for Serum C-Peptide and Its Use in Harmonization in China[J]. Ann Lab Med, 2023,43(4):345-354. DOI: 10.3343/alm.2023.43.4.345 .
[13] 中华医学会检验医学分会临床生化检验学组,中国医学装备协会检验医学分会. 医疗机构临床质谱实验室建设共识[J]. 中华检验医学杂志, 2023,46(8):783-791. DOI: 10.3760/cma.j.cn114452-20221122-00696 .
[14] 戴国梁,居文政,谈恒山. 生物样品前处理研究进展[J]. 中国医院药学杂志, 2013,33(6):484-487. DOI: 10.13286/j.cnki.chinhosppharmacyj.2013.06.026 .
[15] Sealey JE , Gordon RD , Mantero F . Plasma renin and aldosterone measurements in low renin hypertensive states[J]. Trends Endocrinol Metab, 2005,16(3):86-91. DOI: 10.1016/j.tem.2005.02.006 .
[16] Clinical and Laboratory Standards Institute. CLSI Document C62-A: liquid chromatography-mass spectrometry methods; approved guideline[S]. Wayne, PA:Clinical and Laboratory Standards Institute, 2014.
[17] Yu S , Zhou W , Yu J ,et al. An automated magnetic bead extraction method for measuring plasma metanephrines and 3-methoxytyramine using liquid chromatography tandem mass spectrometry[J]. Anal Bioanal Chem, 2022,414(11):3541-3549. DOI: 10.1007/s00216-022-03984-x .
[18] Ueyanagi Y , Setoyama D , Kawakami D ,et al. Fully Automated Quantitative Measurement of Serum Organic Acids via LC-MS/MS for the Diagnosis of Organic Acidemias: Establishment of an Automation System and a Proof-of-Concept Validation[J]. Diagnostics (Basel), 2021,11(12):2195. DOI: 10.3390/diagnostics11122195 .
[19] Leonard M , Dunn J , Smith G . A clinical biomarker assay for the quantification of d3-creatinine and creatinine using LC-MS/MS[J]. Bioanalysis, 2014,6(6):745-759. DOI: 10.4155/bio.13.323 .
[20] Xiao Y , Xu YK , Pattengale P ,et al. A Rapid High-Performance LC-MS/MS Method for Therapeutic Drug Monitoring of Voriconazole, Posaconazole, Fluconazole, and Itraconazole in Human Serum[J]. J Appl Lab Med, 2017,1(6):626-636. DOI: 10.1373/jalm.2016.022756 .
[21] 杨应松,钟志来,李秋丽,等. 串联质谱在新生儿遗传代谢性疾病筛查中的应用[J]. 实用医技杂志, 2018,25(12):1350-1351. DOI: 10.19522/j.cnki.1671-5098.2018.12.012 .
[22] Konieczna L , Kaźmierska K , Roszkowska A ,et al. The LC-MS method for the simultaneous analysis of selected fat-soluble vitamins and their metabolites in serum samples obtained from pediatric patients with cystic fibrosis[J]. J Pharm Biomed Anal, 2016,124:374-381. DOI: 10.1016/j.jpba.2016.03.021 .
[23] Meunier C , Blondelle D , Faure P ,et al. Development and validation of a method using supported liquid extraction for aldosterone determination in human plasma by LC-MS/MS[J]. Clin Chim Acta, 2015,447:8-15. DOI: 10.1016/j.cca.2015.05.007 .
[24] Jia Y , Liu X , Xu L ,et al. Liquid chromatography-tandem mass spectrometry measurement of 26 steroid hormones in human serum and plasma samples[J]. J Sep Sci, 2021,44(12):2358-2370. DOI: 10.1002/jssc.202100091 .
[25] Chen Y , Yazdanpanah M , Wang XY ,et al. Direct measurement of serum free testosterone by ultrafiltration followed by liquid chromatography tandem mass spectrometry[J]. Clin Biochem, 2010,43(4-5):490-496. DOI: 10.1016/j.clinbiochem.2009.12.005 .
[26] William Wu W , McPhaul MJ , Wu Z . Quantitation of Free Thyroxine by Equilibrium Dialysis and Liquid Chromatography-Tandem Mass Spectrometry[J]. Methods Mol Biol, 2022,2546:485-492. DOI: 10.1007/978-1-0716-2565-1_43 .
[27] Yuan C , Kosewick J , He X ,et al. Sensitive measurement of serum 1α, 25-dihydroxyvitamin D by liquid chromatography/tandem mass spectrometry after removing interference with immunoaffinity extraction[J]. Rapid Commun Mass Spectrom, 2011,25(9):1241-1249. DOI: 10.1002/rcm.4988 .
[28] 中国医师协会检验医师分会临床质谱检验医学专业委员会. MS/MS技术在新生儿氨基酸、有机酸及脂肪酸氧化代谢障碍性疾病筛查中的应用共识[J]. 检验医学, 2019,34(6):479-485. DOI: 10.3969/j.issn.1673-8640.2019.06.001 .